Comprendre l'effet Warburg : les exigences métaboliques de la prolifération cellulaire
Par CrossFit
Dans cet article influent de 2009, Matthew Vander Heiden, Lewis Cantley et Craig Thompson proposent une explication alternative à l'effet Warburg. Les auteurs soutiennent que les cellules cancéreuses dépendent fortement de la glycolyse aérobie, non pas pour des raisons liées aux besoins énergétiques, mais plutôt pour créer les substrats d'une prolifération cellulaire rapide.
En arrière-plan : Une molécule de glucose peut être décomposée selon trois processus pertinents pour cette discussion. La phosphorylation oxydative est le principal processus utilisé par les cellules normales en présence d'oxygène et fournit 36 molécules d'ATP pour chaque molécule de glucose consommée. Lorsqu'une cellule normale manque d'oxygène, elle est obligée d'utiliser la glycolyse anaérobie, qui décompose le glucose en lactate et ne génère que deux molécules d'ATP pour chaque molécule de glucose. Les cellules cancéreuses utilisent plutôt la glycolyse aérobie, décomposant le glucose en lactate même en présence d'oxygène et délivrant quatre molécules d'ATP pour chaque molécule de glucose consommée.
Vander Heiden et al. notent d'abord une analogie entre les cellules cancéreuses et les organismes unicellulaires. Alors que les organismes unicellulaires se trouvent dans un environnement riche en nutriments abondants, ils orientent le métabolisme vers des processus qui génèrent de la biomasse, de l'éthanol et des acides organiques pour favoriser la prolifération ; à l'inverse, lorsque l'énergie est rare, ils cherchent à maximiser l'énergie extraite des nutriments disponibles. Dans les organismes multicellulaires, la prolifération incontrôlée est généralement supprimée, de sorte que les cellules maximisent l'extraction d'énergie plutôt que la production de biomasse. Les cellules cancéreuses, quant à elles, absorbent et utilisent des nutriments comme un organisme unicellulaire dans un état prolifératif.
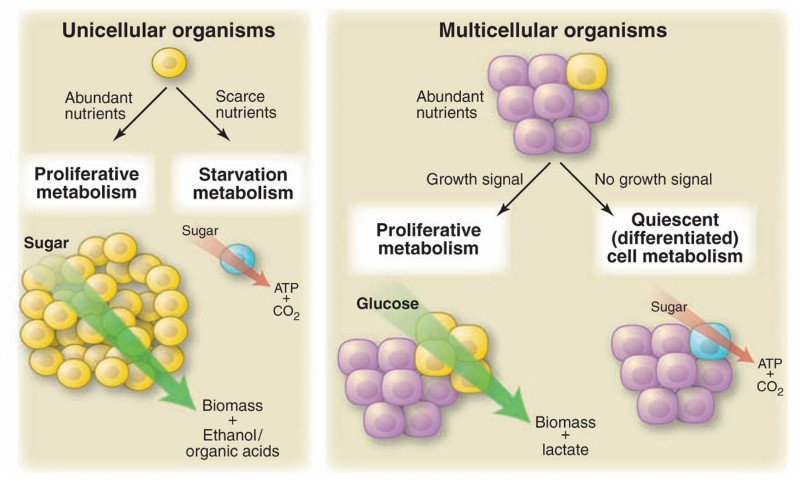
En 1924, Otto Warburg a noté que les cellules cancéreuses, contrairement aux tissus normaux, fermentent le glucose en lactate même lorsqu'il y a suffisamment d'oxygène pour soutenir la phosphorylation oxydative (c'est-à-dire qu'elles effectuent la glycolyse aérobie). En d'autres termes, les cellules cancéreuses métabolisent le glucose, en utilisant des voies qui génèrent moins d'énergie (ATP) par molécule de glucose consommée malgré les ressources nécessaires pour utiliser un processus plus efficace. Bien que l'observation soit largement reconnue, il n'y a aucune explication reconnue pour expliquer pourquoi les cellules cancéreuses se comportent de cette façon.
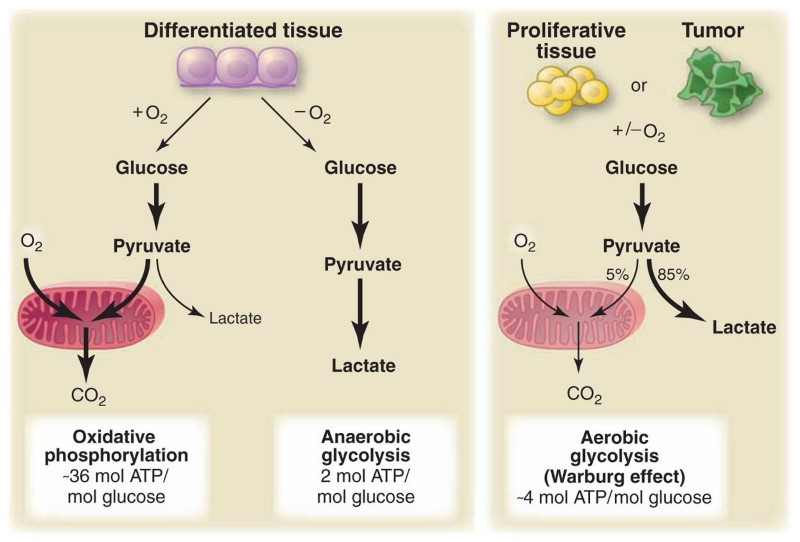
La croissance rapide des cellules cancéreuses (et des études mécanistiques plus poussées) démontre que leur utilisation de la glycolyse aérobie ne les empêche pas de générer suffisamment d'énergie pour survivre et se reproduire. Au lieu de ça, soutiennent les auteurs, la contrainte la plus pressante sur la prolifération peut être la production des nucléotides, des acides aminés et des lipides nécessaires pour répliquer tout le contenu de la cellule avant la mitose. Alors que la production de ces constituants bruts de la croissance, tels que le palmitate et les acides aminés, nécessite un peu d'ATP, leurs besoins en carbone et autres substrats sont plus importants par rapport à ce que le glucose peut fournir.
À titre d'exemple de ces exigences : « pour fabriquer une chaîne acyle gras à 16 carbones, une seule molécule de glucose peut fournir cinq fois l'ATP requis, tandis que 7 molécules de glucose sont nécessaires pour générer le NADPH requis ». En d'autres termes, si la majorité du glucose est engagée dans la production d'ATP, la cellule aura un substrat insuffisant pour répliquer rapidement son contenu et proliférer. Cela est vrai pour une variété de molécules, car le glucose et la glutamine "fournissent la majeure partie du carbone, de l'azote, de l'énergie libre et des équivalents réducteurs nécessaires pour soutenir la croissance et la division cellulaires".
![img:Comprendre Figure 3, Les voies
métaboliques actives dans les cellules en prolifération sont directement
contrôlées par des voies de signalisation impliquant des oncogènes connus et
des gènes suppresseurs de tumeurs. Ce schéma montre notre compréhension
actuelle de la façon dont la glycolyse, la phosphorylation oxydative, la voie
des pentoses phosphates et le métabolisme de la glutamine sont interconnectés
dans les cellules en prolifération. Ce câblage métabolique permet à la fois la
production de NADPH et le flux d'acétyl-CoA vers le cytosol pour la synthèse
des lipides. Les étapes clés de ces voies métaboliques peuvent être influencées
par des voies de signalisation connues pour être importantes pour la
prolifération cellulaire. L'activation des récepteurs du facteur de croissance
conduit à la fois à la signalisation de la tyrosine kinase et à l'activation de
PI3K. Via AKT, l'activation de PI3K stimule l'absorption et le flux de glucose
à travers la première partie de la glycolyse. La signalisation de la tyrosine kinase
régule négativement le flux à travers les dernières étapes de la glycolyse,
rendant les intermédiaires glycolytiques disponibles pour la synthèse
macromoléculaire et soutenant la production de NADPH. Myc stimule le
métabolisme de la glutamine, qui soutient également la production de NADPH. La
signalisation LKB1/AMPK et p53 diminuent le flux métabolique par glycolyse en
réponse au stress cellulaire. Une diminution du flux glycolytique en réponse à
LKB/AMPK ou p53 peut être une réponse adaptative pour arrêter le métabolisme
prolifératif pendant les périodes de faible disponibilité énergétique ou de
stress oxydatif. Les suppresseurs de tumeurs sont indiqués en rouge et les
oncogènes sont en vert. Les voies métaboliques clés sont étiquetées en violet
avec des cases blanches, et les enzymes contrôlant les étapes critiques de ces
voies sont indiquées en bleu. Certaines de ces enzymes sont candidates comme
nouvelles cibles thérapeutiques dans le cancer. L'enzyme malique fait référence
à la malate déshydrogénase spécifique de NADP+ [nom systématique
(S)-malate : NADP+ oxydoréductase (oxaloacétate-décarboxylant)]. De Understanding the
Warburg Effect,The Metabolic Requirements of Cell Proliferation.](https://r2training.fr/files/medias/150Fig3-Warburg.png)
Ainsi, les auteurs postulent que le métabolisme du glucose et de la glutamine dans une cellule cancéreuse en prolifération est conçu pour maximiser la production de blocs de construction cellulaire plutôt que la production d'énergie. L'état prolifératif est ainsi « activé » par une augmentation simultanée de l'acquisition de nutriments par les cellules tumorales et un glissement vers des voies métaboliques favorisant la prolifération.
Lisez UNDERSTANDING THE WARBURG EFFECT.
Retrouvez l'article original ici.